Оригинальные исследования 
АКТУАЛЬНОСТЬ. В терапии сахарного диабета (СД) для стойкого снижения уровня глюкозы в крови широко применялся глибенкламид — блокатор КАТФ-каналов. Однако его воздействие на мозговую циркуляцию исследовано очень мало. Понижение функциональной активности КАТФ-каналов вследствие их блокирования глибенкламидом на фоне развившейся эндотелиальной дисфункции может привести к нарушению мозговой циркуляции (особенно на микроциркуляторном уровне) и способствовать ремоделированию сосудистой сети.
ЦЕЛЬ. Оценить влияние глибенкламида на реактивность церебральных артерий у крыс со стрептозотоциновым сахарным диабетом (СТЗ-СД).
ЗАДАЧИ. 1. Изучить изменение функционального состояния КАТФ-каналов пиальных артерий при СТЗ-СД. 2. Оценить влияние глибенкламида на участие КАТФ-каналов в формировании базального тонуса и эндотелий-зависимой дилатации пиальных артерий.
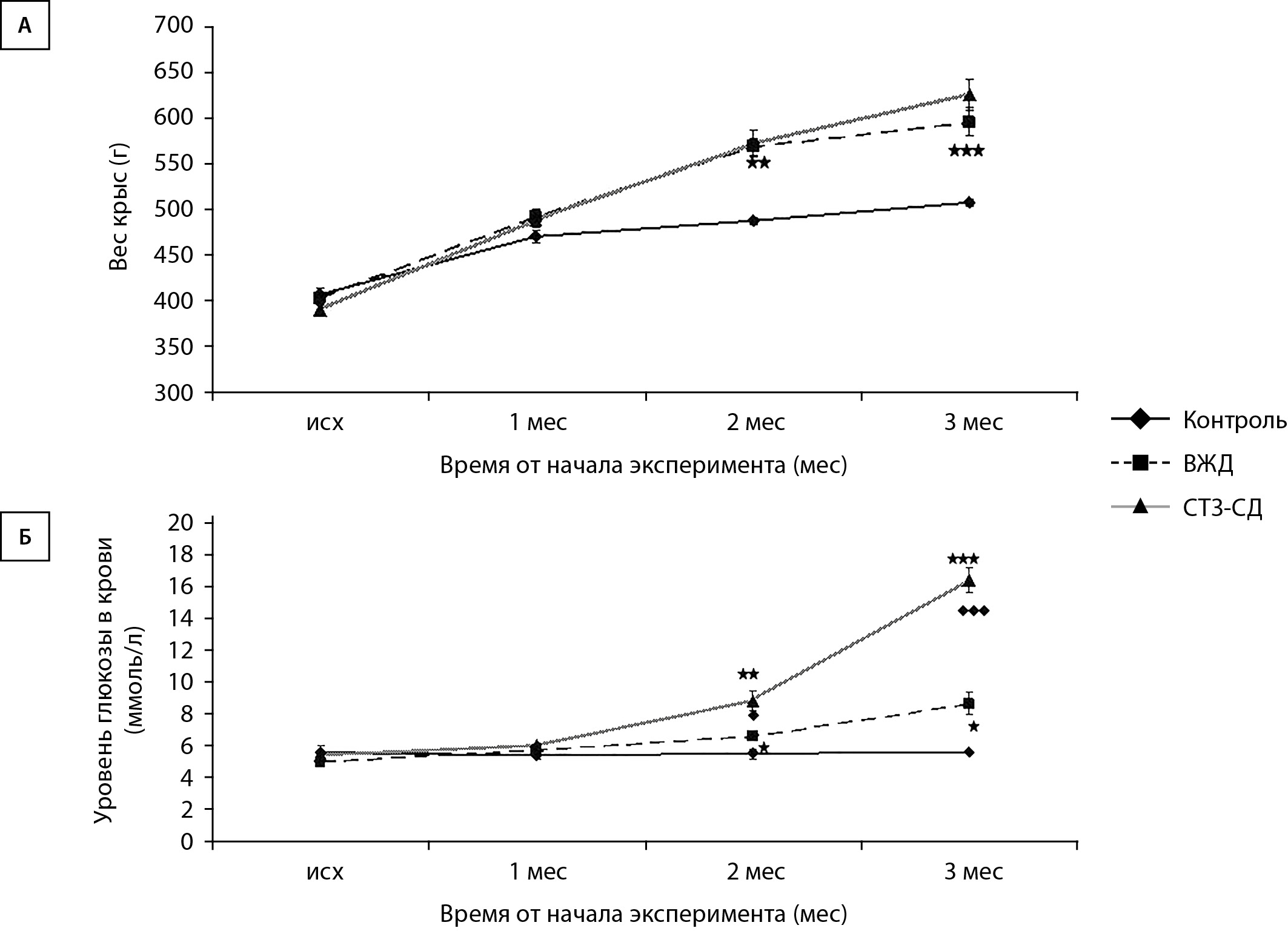
МАТЕРИАЛЫ И МЕТОДЫ. Работа проведена на 54 крысах-самцах линии Sprague Dawley. СТЗ-СД был смоделирован посредством содержания животных на высокожировой диете и введении стрептозотоцина (35 мг/кг). С помощью установки для прижизненного изучения реактивности пиальных сосудов через 3 мес с начала эксперимента измеряли диаметр артерий при орошении поверхности мозга растворами Кребса-Хенселейта, ацетилхолина, глибенкламида, пинацидила и ацетилхолина на фоне действия глибенкламида или пинацидила.
РЕЗУЛЬТАТЫ. При моделировании СТЗ-СД крыс развились толерантность к глюкозе, инсулинорезистентность (ИР); относительно контрольных животных масса тела была больше в 1,3 раза, процентное содержание висцерального жира — в 3 раза, уровень глюкозы в крови — в 3,2 раза. Показали, что при СТЗ-СД число констрикций пиальных артерий под действием глибенкламида уменьшилось в 1,3–1,9 раза по сравнению с интактными крысами. Глибенкламид не блокировал эндотелий-зависимую дилатацию.
ЗАКЛЮЧЕНИЕ. У крыс со СТЗ-СД КАТФ-каналы принимают участие в формировании базального тонуса пиальных артерий, но вклад этих каналов снижен в среднем в 1,5 раза по сравнению со здоровыми крысами.
Применение глибенкламида при СТЗ-СД не влияет на эндотелий-зависимую дилатацию церебральных артерий.
ОБОСНОВАНИЕ. Сахарный диабет 1 типа (СД1) — хроническое аутоиммунное заболевание, характеризующееся поражением инсулинопродуцирующих клеток поджелудочной железы, что со временем приводит к потребности в заместительной инсулинотерапии. Клиническая картина СД1 гетерогенна: начало заболевания в раннем возрасте характеризуется более острой манифестацией и быстрым истощением остаточной секреции инсулина. Вариации HLA-генов, вероятно, могут определять клинические особенности течения СД1. Установлены возрастные особенности HLA-генов в различных популяциях, однако для российской популяции такие данные отсутствуют.
ЦЕЛЬ. Изучить влияние HLA-генов на предрасположенность к СД1 в дошкольном возрасте.
МАТЕРИАЛЫ И МЕТОДЫ. Одноцентровое одномоментное исследование, включающее 885 детей (1–18 лет) с СД1, находящихся на интенсифицированной инсулинотерапии. Участники разделены на две группы: с манифестацией СД1 <7 лет и ≥7 лет. Проанализированы возраст диагностики СД1, SDS индекса массы тела, уровни гликированного гемоглобина (HbA1c) и С-пептида, частота выявления аутоантител к глутаматдекарбоксилазе (GADA), тирозинфостфазе (IA-2А), транспортеру цинка (ZnT8A), генов HLA I и II классов.
РЕЗУЛЬТАТЫ. В группе с манифестацией СД1 <7 лет выявлены более низкие показатели С-пептида (0 против 0,3 нг/мл, р<0,001), реже определялись АТ GADA (48% против 67%, р=0,028), IA-2 (52% против 62%, р=0,014), ZnT8 (44% против 71%, р=0,002). Не было значимых различий по полу, уровню HbA1c и SDS ИМТ. В группе с манифестацией СД1<7 лет отмечалась большая частота наиболее сильного предрасполагающего генотипа DRB1*03-DQA1*05:01-DQB1*02:01 (DR3-DQ2)/DRB1*04-DQA1*03:01-DQB1*03:02 (DR4-DQ8) (27,5% против 21,5%, p=0,039]) и меньшая частота протекторного гаплотипа DRB1*01-DQA1*01-DQB1*05:01 (19,1% против 24,9%, р=0,035). В группе с манифестацией <7 лет была большая частота предрасполагающего гаплотипа A*24:02 (35,6% против 24,1%, р=0,002). Независимо от возраста начала и длительности заболевания, отсутствие остаточной секреции С-пептида (<0,1нг/мл) было связано с предрасполагающим гаплотипом DR4-DQ8 (65,7% против 60,8%, р=0,04) и B*18:01 (20,9% против 16,9%, р=0,026), с меньшей частотой протекторных гаплотипов DRB1*15-DQA1*01:03-DQB1*06:03 или DRB1*15-DQA1*01:02-DQB1*06:02 (1,3% против 3,3%, р=0,047). Наличие IA-2А и ZnT8А было ассоциировано с гаплотипом DR4-DQ8 (28,2% против 16,5%, р=0,037, и 33,3% против 15,4%, р=0,018). GADА связаны с предрасполагающим гаплотипом DR3-DQ2 (55,0% против 34,5%, р=0,03).
ЗАКЛЮЧЕНИЕ. В российской популяции установлены предрасполагающие и протекторные HLA гаплотипы I и II класса, связанные с манифестацией СД1 в дошкольном возрасте и резервной функцией бета-клеток. Показана взаимосвязь наличия островковых АТ с предрасполагающими DR3/DR4 гаплотипами, что может определять различные механизмы формирования и течения аутоиммунного процесса.
ОБОСНОВАНИЕ. Молекулярно-генетические исследования (МГИ) становятся более доступными, что улучшило диагностику моногенных форм сахарного диабета (СД). Среди них наиболее распространен диабет «зрелого типа» у молодых — MODY. Большинство исследований MODY проводились среди детей и посвящены клиническим проявлениям и генетическим особенностям MODY. Однако диагностика MODY возможна в возрасте >18 лет. Федеральный регистр сахарного диабета (ФРСД) — уникальная база данных, содержащая информацию о пациентах с MODY, что позволит оценить ведение таких больных в реальной клинической практике.
ЦЕЛЬ. Проанализировать клинические особенности дебюта СД, состояния углеводного обмена, осложнения и сахароснижающую терапию (СТ) у пациентов с основными типами MODY на основании данных ФРСД.
МАТЕРИАЛЫ И МЕТОДЫ. Одномоментное сравнительное исследование с ретроспективным анализом данных. Включены все пациенты, у которых по состоянию на 01.06.2023 г. указан тип СД: «Генетические дефекты функции b-клеток (MODY1), (MODY2), (MODY3), (прочие MODY)». Указанный конкретный тип MODY рассматривался как результат проведенного МГИ. Непосредственные результаты МГИ в ФРСД не фиксируются.
РЕЗУЛЬТАТЫ. В исследование включено 640 пациентов. Среди пациентов с указанными типами MODY 69,4% имели диагноз MODY2 (n=331), 18,2% (n=87) — MODY1, 12,4% (n=59) — MODY3. У 163 человек тип MODY не указан. MODY диагностировался в возрасте до 18 лет у 71,4% пациентов. Медиана возраста диагностики СД составила для MODY1 — 19 [13; 36], MODY2 — 10 [5; 15], MODY3 — 14 [11; 21] лет. Длительность наблюдения — 6 [3; 9] лет.
Только 61% пациентов с MODY2 получали монотерапию диетой, остальные — различную СТ. Препараты сульфонилмочевины получали 45,8% пациентов с MODY3 и 14,1% с MODY1. Инсулинотерапия чаще назначалась при MODY1 и 3 (35,9 и 31,2%). Целевой уровень гликированного гемоглобина (HbA1c) отмечался у 82% пациентов с MODY2 и 50,7% и 52,9% — с MODY1 и 3.
Диабетические осложнения наблюдались у 6,04% пациентов с MODY2, 23,0% — с MODY1 и 22,0% — с MODY3. Диабетическая ретинопатия — у 5,75, 1,21 и 3,39% пациентов с MODY1, MODY2, MODY3 соответственно; диабетическая нефропатия — у 10,3, 2,11, 11,9%; диабетическая полинейропатия – у 14,9, 4,53, 15,3%.
ЗАКЛЮЧЕНИЕ. Данные ФРСД позволили проанализировать распространенность, особенности течения основных типов MODY, характер и эффективность СТ в реальной клинической практике. Отражено отсутствие единых подходов в лечении MODY, часто необоснованное назначение инсулинотерапии, что наряду с ожидаемым увеличением количества пациентов с MODY указывает на необходимость разработки клинических рекомендаций по ведению данных пациентов.
АКТУАЛЬНОСТЬ. Гестационный сахарный диабет (ГСД) — одно из наиболее часто встречающихся заболеваний во время беременности, распространенность которого будет увеличиваться. На сегодняшний день имеются данные, показывающие, что не все беременные с ГСД имеют одинаковые риски развития акушерских и перинатальных осложнений. Выделение пациенток с повышенным риском развития осложнений может оказаться необходимым с учетом увеличения распространенности ГСД. Потребность в более детальном изучении подтипов ГСД, разработки методов диагностики подтипов для определения пациенток с высоким риском осложнений легла в основу исследования.
ЦЕЛЬ ИССЛЕДОВАНИЯ. Определение анамнестических, фенотипических и биохимических характеристик подтипов ГСД для дальнейшей разработки методов диагностики и лечения.
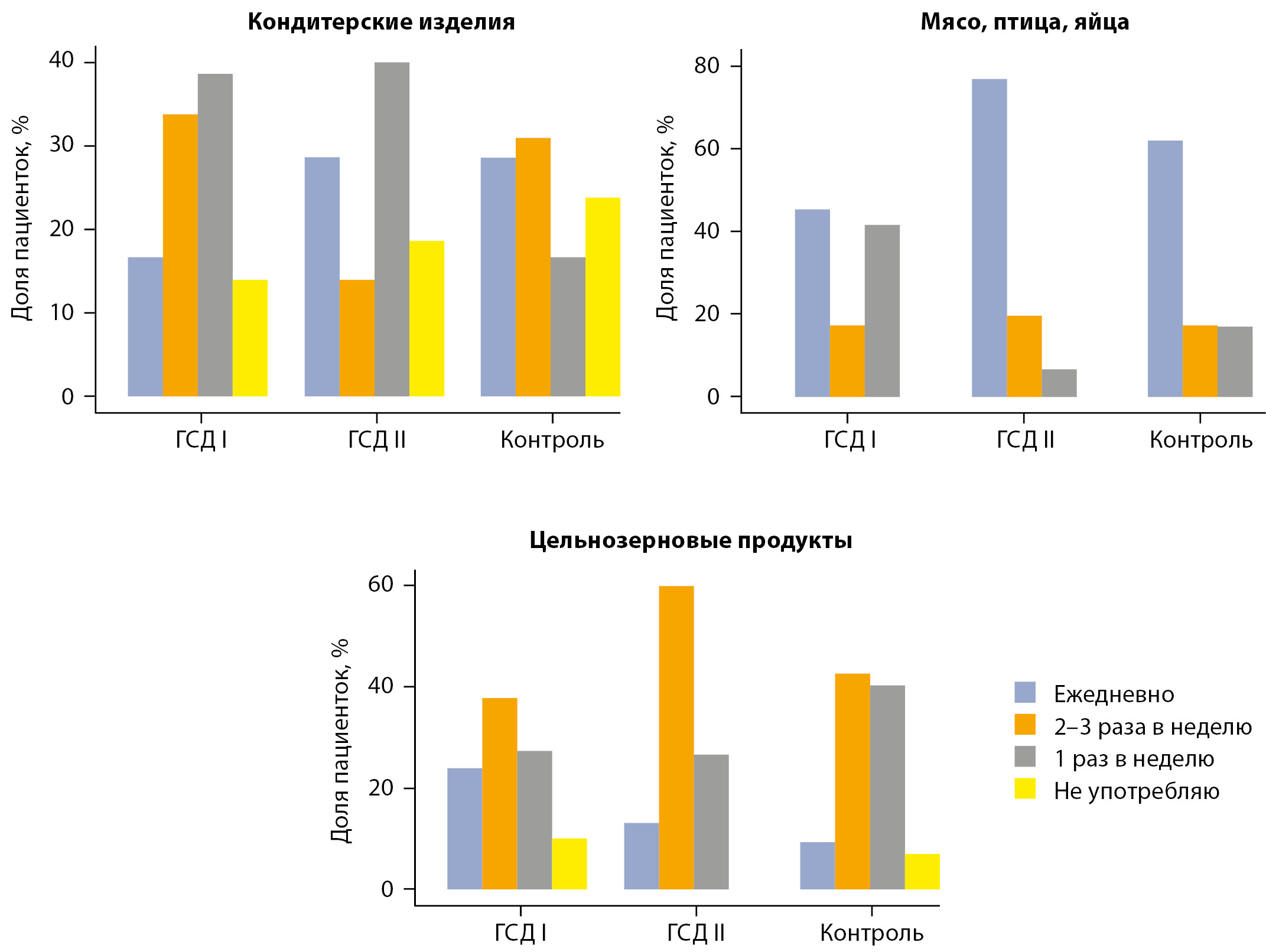
МАТЕРИАЛЫ И МЕТОДЫ. Одноцентровое наблюдательное проспективное исследование выполнено на базе кафедры внутренних болезней №3 ФГБОУ ВО Ростовского государственного медицинского университета Минздрава Российской Федерации в период с апреля 2021-го по август 2022 гг. В исследование включены 130 беременных женщин. Участницам проводился пероральный глюкозотолерантный тест с 75 г глюкозы с оценкой уровня глюкозы венозной плазмы и инсулина натощак, через 60 и 120 минут проводился забор крови натощак для определения уровней общего холестерина, триглицеридов, липопротеинов высокой плотности, липопротеинов низкой плотности, аполипопротеина А, аполипопротеина В, адипонектина, лептина и оментина, гликированного гемоглобина, С-реактивного белка. Все участницы исследования прошли сбор анамнеза и физикальный осмотр с оценкой индекса массы тела (ИМТ), артериального давления, признаков acanthosis nigricans, анкетирование. При обнаружении ГСД проводились расчеты индекса Matsuda: при получении значения >50-го процентиля в сравнении со значениями беременных без нарушений углеводного обмена мы классифицировали пациентку как имеющую ГСД с преобладающей дисфункцией β-клеток. Если значение индекса составляло <50-го процентиля, мы относили пациентку в группу ГСД с преобладающей инсулинорезистентностью.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ. Беременные с выраженной инсулинорезистентностью были старше, имели выше ИМТ до наступления беременности, большую прибавку веса с момента зачатия и до конца второго триместра, чаще имели признаки acanthosis nigricans в сравнении с пациентками с ГСД и дисфункцией β-клеток. Также при сравнении пациенток с различными подтипами ГСД были выявлены многочисленные биохимические различия (по уровням триглицеридов, аполипоротеинов А и В, С-реактивного белка, гликированного гемоглобина и адипонектина). Помимо этого, выявлены особенности питания и физической активности.
ЗАКЛЮЧЕНИЕ. Мы продемонстрировали выраженные анамнестическую, фенотипическую и биохимическую неоднородность у пациенток с различными подтипами ГСД, что может стать основной для дальнейшей разработки способа верификации подтипов ГСД.
ОБОСНОВАНИЕ. На сегодняшний день результаты применения метформина, гозоглиптина и их комбинации не изучены на большой популяции пациентов с сахарным диабетом 2 типа (СД2), включая коморбидных пациентов, в реальных клинических условиях Российской Федерации.
ЦЕЛЬ. Оценить эффективность, безопасность, приверженность и удовлетворенность пациентов с СД2 лечением при применении сахароснижающих препаратов метформина и гозоглиптина и их комбинации в рутинной клинической практике.
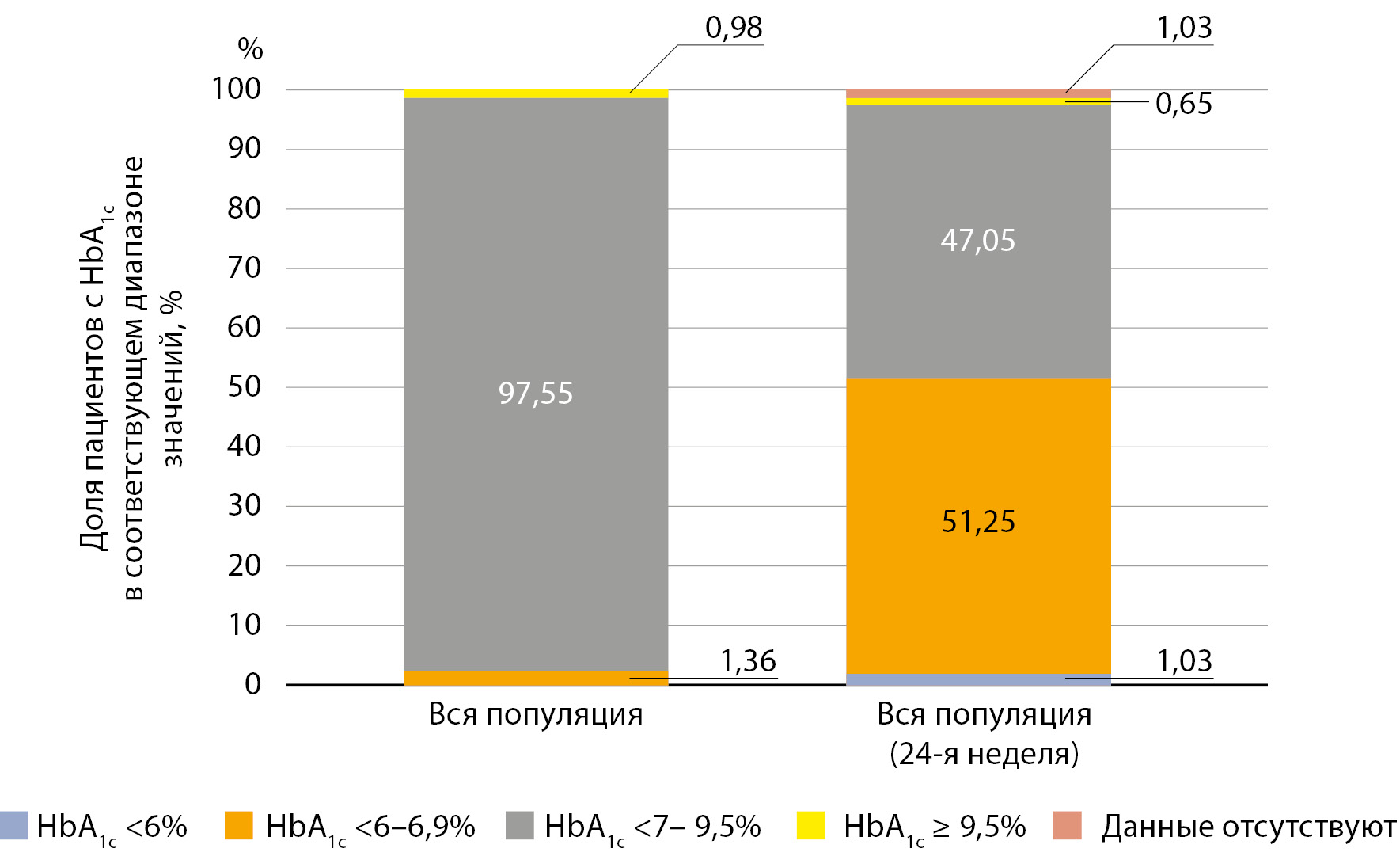
МАТЕРИАЛЫ И МЕТОДЫ. Всероссийское многоцентровое наблюдательное исследование «ПАЛИТРА» проводилось среди больных СД2, которым в условиях повседневной клинической практики была назначена терапия метформином или гозоглиптином или их комбинацией. Группы формировались в соответствии с принимаемым сахароснижающим препаратом; в общей сложности приняли участие 5741 пациент с СД2 в возрасте 18–65 лет с широким профилем коморбидности. Период наблюдения — 6 мес. Исходно и через 3 и 6 мес от начала терапии изучаемыми препаратами регистрировали массу тела, индекс массы тела (ИМТ), артериальное давление (АД), уровень гликированного гемоглобина (HbA1c), показатели гликемии, биохимические показатели (АЛТ, АСТ, креатинин плазмы крови). Оценку приверженности получаемой терапии и удовлетворенности лечением пациентом и врачом проводили с использованием шкалы Лайкерта.
РЕЗУЛЬТАТЫ. Уровень HbA1c к 24 неделе снизился на 1,03% в группе, получавшей монотерапию метформином, и на 0,95% — в группах, где применялась монотерапия гозоглиптином и комбинация из двух препаратов — метформина и гозоглиптина. В конце исследования 49,6% пациентов с СД2 достигли целевого уровня HbA1c (<7,0%). Доля пациентов с уровнем HbA1c менее 7,0% составила 61,0% в группе, принимавшей метформин, и 47,75 и 47,2% в группах, получавших гозоглиптин и двойную комбинацию метформин/гозоглиптин соответственно. Частота эпизодов гипогликемий была очень низкой на протяжении всего периода наблюдения, в течение которого масса тела незначительно снижалась. Показана высокая удовлетворенность пациентов и врачей проводимым лечением СД2. Это нашло отражение в высоких баллах по шкале Лайкерта.
ЗАКЛЮЧЕНИЕ. Высокая эффективность, безопасность применения (низкая частота развития гипогликемии и отсутствие влияния на массу тела) метформина, гозоглиптина и комбинации из этих двух препаратов, приверженность проводимой сахароснижающей терапии, удовлетворенность лечением пациентов и врачей в программе «ПАЛИТРА» продемонстрирована на достаточном количестве российских пациентов с СД2, имеющих широкий профиль коморбидности.
ОБОСНОВАНИЕ. Учитывая роль депонирования висцеральной жировой ткани в патогенезе хронической сердечной недостаточности с сохраненной фракцией выброса (ХСНсФВ), а также положительное влияние метформина на снижение массы тела, вызывает интерес влияние данного препарата на компартменты жировой ткани у пациентов с ХСНсФВ.
ЦЕЛЬ. Изучить влияние метформина пролонгированного действия (XR) на различные жировые депо и параметры инсулин-глюкозного гомеостаза у пациентов с ХСНсФВ, предиабетом и абдоминальным ожирением (АО).
МАТЕРИАЛЫ И МЕТОДЫ. Дизайн исследования: одноцентровое, открытое, рандомизированное, проспективное, контролируемое. Регистрационный номер исследования в регистре НАРНИС РНИ.25.004. В исследование включено 64 человека (50% мужчины, медиана возраста 58 [55,25; 59,75] лет) с ХСНсФВ, предиабетом и АО. Все пациенты (группы А и В) получали оптимальную терапию ХСНсФВ. В группе А (n=32) дополнительно назначался метформин XR 1000–1500 мг/сут. Всем пациентам проводилось общеклиническое обследование, расчет индексов инсулинорезистентности, ультразвуковая липометрия с определением толщины эпикардиального, предбрюшинного и подкожного жира исходно и через 6 месяцев наблюдения.
РЕЗУЛЬТАТЫ. У пациентов группы А отмечено снижение окружности талии на 0,9% (р=0,002), окружности бедер на 1,25% (р=0,001), массы тела на 4,7% (р<0,0001), индекса массы тела на 1,8% (р=0,001) по сравнению с исходными значениями. В контрольной группе антропометрические параметры динамики не претерпели. Также в группе приема метформина XR продемонстрировано снижение уровня глюкозы на 4,6% (р=0,009), гликированного гемоглобина — на 3,3% (р=0,047), инсулина — на 12,5% (р=0,024) и индексов инсулинорезистентности: HOMA-IR — на 19,8% (р=0,009), FIRI — на 19,8% (р=0,009). У пациентов из группы В, напротив, наблюдалось повышение уровня инсулина плазмы натощак на 33,6% (р=0,035), с увеличением значений индексов HOMA-IR на 27,4% (р=0,026) и FIRI на 26,9% (р=0,025). Динамика параметров ультразвуковой липометрии наблюдалась только в группе А: толщина предбрюшинного жира снизилась на 14,5% (р<0,0001), толщина подкожного уменьшилась на 12,3% (р<0,0001).
ЗАКЛЮЧЕНИЕ. У пациентов с предиабетом, ХСНсФВ и АО прием метформина XR 1000–1500 мг/сут в течение 6 месяцев на фоне оптимальной базовой терапии ХСН был ассоциирован со снижением количества как подкожного, так и предбрюшинного жира, а также оказал благоприятное воздействие на параметры метаболизма глюкозы по сравнению с группой контроля.
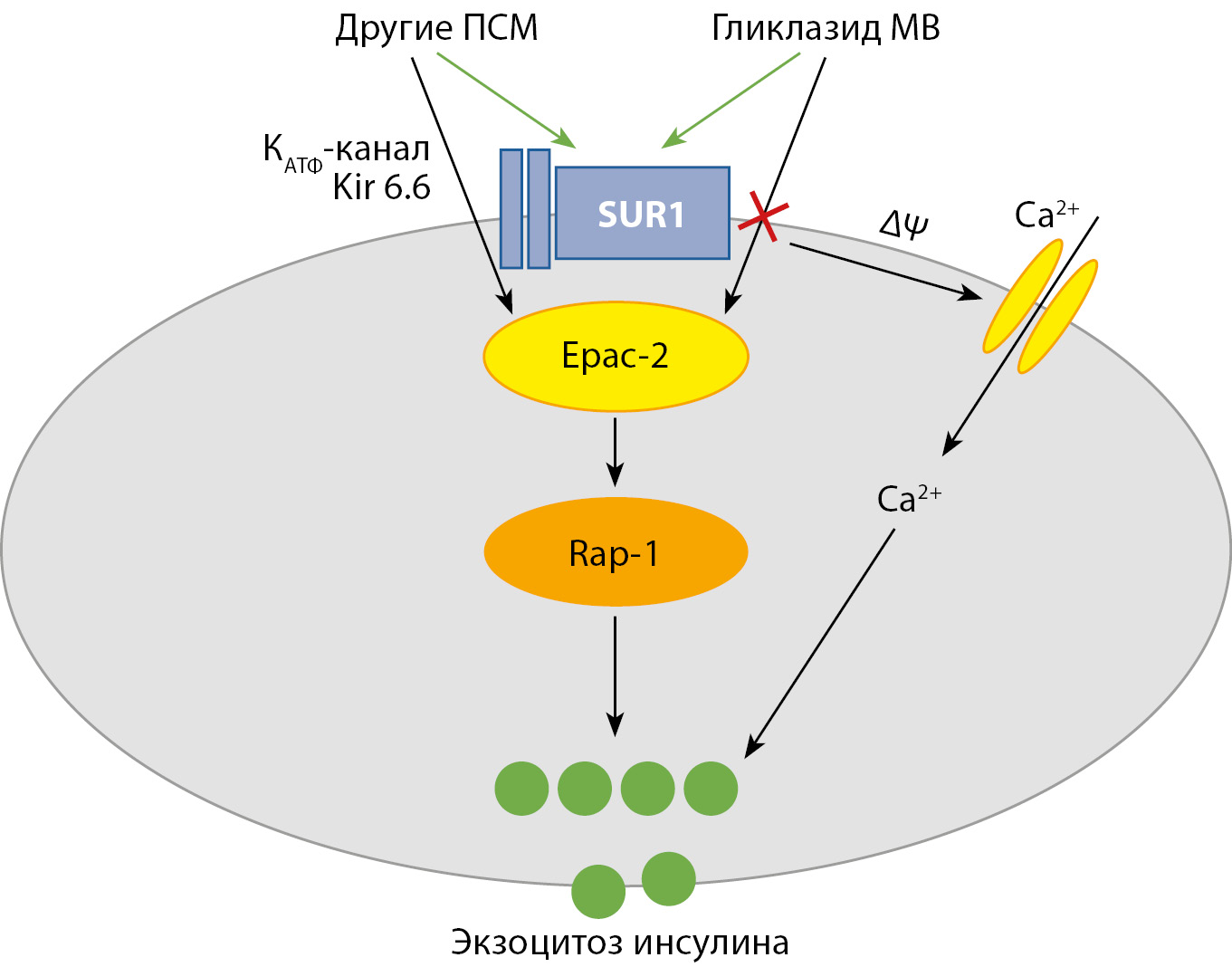
Производные сульфонилмочевины (ПСМ) являются эффективными классом пероральных сахароснижающих препаратов, более 70 лет использующихся в клинической практике. Несмотря на общий механизм действия, для представителей класса характерны значимые внутриклассовые отличия по сахароснижающей активности, безопасности и наличию внепанкреатических эффектов. В данном обзоре рассматриваются особенности гликлазида с модифицированным высвобождением (MВ), его отличия от других представителей класса ПСМ и место в современных рекомендациях по терапии сахарного диабета 2 типа (СД2). Гликлазид МВ относится к современным ПСМ 2 поколения с высокой сахароснижающей активностью, низким риском гипогликемии вследствие обратимого связывания с рецептором SUR1 и отсутствием влияния на Epac2 путь, в целом нейтральным влиянием на вес, имеет доказанные нефропротективные свойства и благоприятный профиль сердечно-сосудистой безопасности, что позволяет выделять его среди представителей класса ПСМ. Международные и национальные клинические рекомендации отмечают место ПСМ при необходимости интенсификации сахароснижающей терапии и гликемического контроля у пациентов с СД2.
ОБОСНОВАНИЕ. Синдром диабетической стопы (СДС) является поздним осложнением сахарного диабета (СД) и основной причиной выполнения нетравматических ампутаций нижних конечностей у больных СД. В настоящее время для лечения и профилактики данного осложнения разработаны и внедрены стандарты оказания медицинской помощи. При этом есть определенный дефицит опубликованных данных об эффективности специализированной помощи, особенно на догоспитальном этапе.
ЦЕЛЬ. Проанализировать исходы язвенных дефектов у больных СД с СДС, получающих лечение в амбулаторном режиме специализированного отделения, и выявить факторы, влияющих на них.
МАТЕРИАЛЫ И МЕТОДЫ. Были проанализированы медицинские карты пациентов с язвенными дефектами при СДС, получающих специализированное лечение в амбулаторном режиме в отделении диабетической стопы. Всем пациентам при первичном осмотре проводилась оценка состояния периферической чувствительности и магистрального кровотока. Лечение назначалось в соответствии с наличием и степенью выраженности инфекции и ишемии пораженной конечности. Анализировалось количество ампутаций на разных уровнях, процент заживших и незаживших ран в течение года. Выявлялись предикторы выполнения высоких ампутаций и отсутствия заживления в течение года.
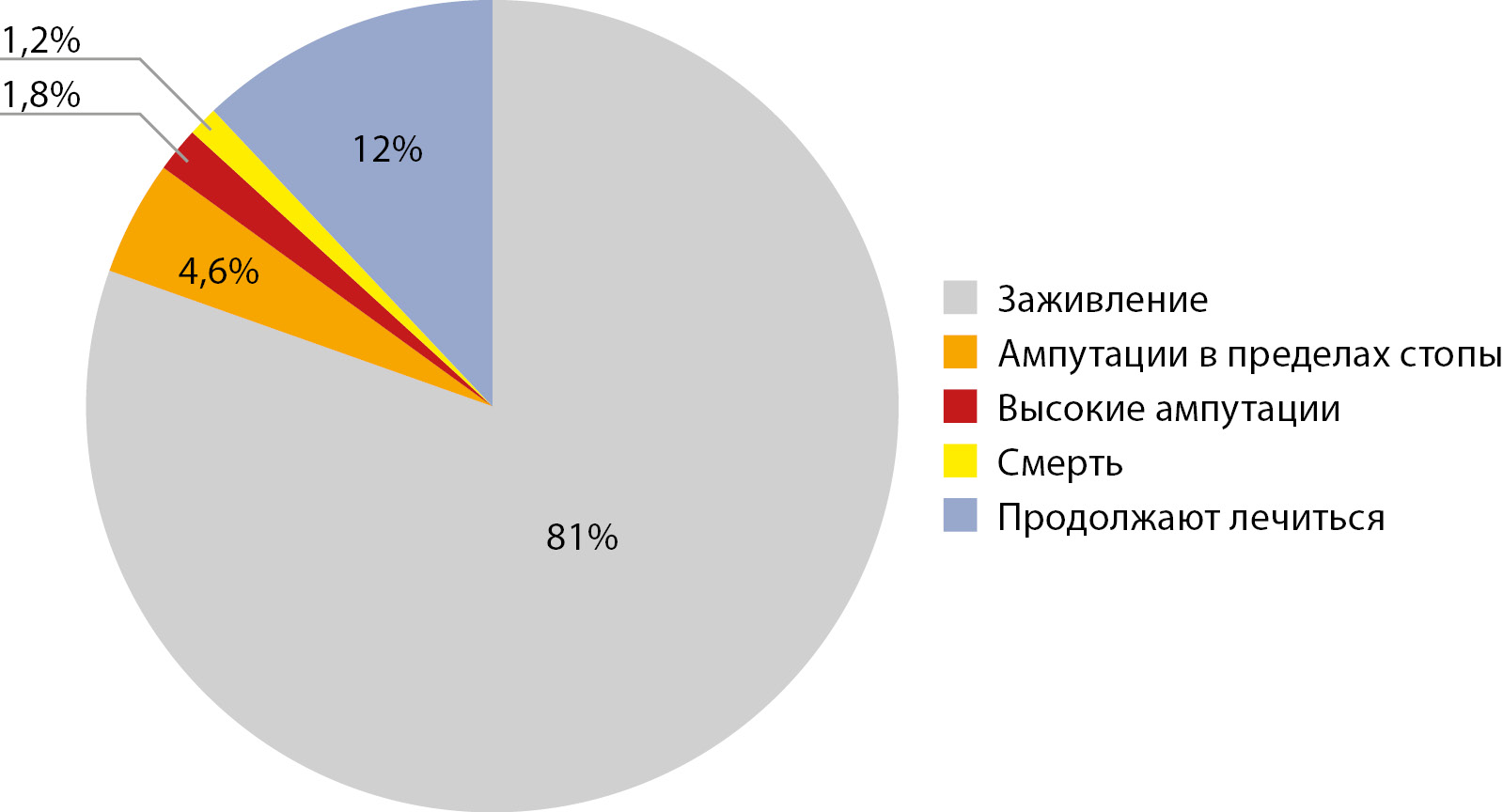
РЕЗУЛЬТАТЫ. Из 503 пациентов с СДС нейропатическая форма была диагностирована у 336 (67%) пациентов, нейро-ишемическая — у 167 (33%). Заживление без выполнения высоких и малых ампутаций в общей когорте пациентов отмечено в 407 случаях (81%). В 32 (7%) случаях потребовалось выполнение ампутаций, из них: 23 (5%) — в пределах стопы, 3 — на уровне голени (0,6%), 6 — на уровне бедра (1,2%). Смерть констатирована у 6 пациентов (1,2%), из них у 2 после выполнения ампутации на уровне бедра. 61 пациент (12%) продолжал лечиться на момент окончания исследования. Предикторами выполнения высоких ампутаций в общей когорте больных стали возраст, нарушение магистрального кровотока в артериях нижних конечностей, глубина язвенного дефекта по Вагнеру и уровень гликированного гемоглобина. Значимыми предикторами отсутствия заживления на фоне консервативных мероприятий в течение года стали: наличие нарушенного магистрального кровотока и несвоевременное обращение за специализированной медицинской помощью.
ЗАКЛЮЧЕНИЕ. Полученные данные продемонстрировали высокую эффективность специализированной помощи больным с язвенными дефектами при СДС на догоспитальном этапе.
Обзоры 
Диабетическая нейроостеоартропатия Шарко — проявление синдрома диабетической стопы, сопровождающееся высоким риском образования трофических язв и ампутации. Многие аспекты этой патологии ввиду ее особенностей остаются плохо изученными, что ведет к сложностям в определении тактики лечения пациентов. В обзоре проводится анализ классификаций артропатии Шарко, построенных по анатомическому и «функциональному» принципам. Основное внимание уделено поражениям среднего отдела стопы как наиболее тяжелым по своим последствиям. Проанализированы преимущества и недостатки разных подходов к описанию рентгенологической картины заболевания на разных его стадиях. Систематизация литературы позволяет сделать вывод о том, что существующие подходы к классификации относительно приемлемы с точки зрения планирования консервативного лечения. В то же время подробные анатомо-рентгенологические классификации не помогают в выборе тактики реконструктивного хирургического лечения. В свете увеличения доступности реконструктивной хирургии при тяжелых деформациях вследствие артропатии Шарко представляется целесообразной разработка классификационных систем, которые могли бы стать инструментом определения хирургической тактики при данной патологии.
Клинический случай 
У женщин репродуктивного возраста с сахарным диабетом 1 типа (СД1) и хронической болезнью почек (ХБП) 5 стадии после успешной сочетанной трансплантации поджелудочной железы и почки (СТПЖП) могут наступать спонтанные беременности с благоприятным исходом. Однако эти беременности ассоциированы с высоким риском осложнений — артериальной гипертензии, преэклампсии, преждевременных родов, прогрессирования диабетической ретинопатии. Во время беременности могут развиваться как гестационный СД, так и спонтанные эпизоды гипогликемии. В данной статье представлено описание клинического случая пациентки 42 лет с СД1, у которой беременность наступила через 2 года после успешной СТПЖП. Артериальной гипертензии не было, состояние глазного дна было стабильным после проведенного ранее лечения. Пациентка получала такролимус и минимальную дозу кортикостероидов, на сроке 13 недель была назначена ацетилсалициловая кислота для профилактики преэклампсии. В 30 недель появились эпизоды гипогликемии в ночное время, которые были купированы дополнительным приемом углеводов со средним гликемическим индексом в сочетании с животными жирами и белками. На сроке 36 недель произошло дородовое излитие околоплодных вод, выполнено кесарево сечение. Родилась здоровая девочка с весом 2140 г, ростом 48 см, оценкой по шкале Апгар 7/8 баллов. У матери функция трансплантатов почки и поджелудочной железы оставалась нормальной. Для пациенток после СТПЖП крайне важными являются прегравидарная подготовка, мультидисциплинарное ведение беременности.
Ошибки 
Ошибка в статье «Недостаточность/дефицит витамина В12 у пациентов в практике эндокринолога» авторского коллектива в составе Мокрышева Н.Г., Шестакова М.В., Аметов А.С., Анциферов М.Б., Бакулин И.Г., Вавилова Т.В., Галстян Г.Р., Демидова Т.Ю., Дзгоева Ф.Х., Каронова Т.Л., Лукина Е.А., Мкртумян А.М., Пономарев Р.В., Супонева Н.А., Сухарева О.Ю., Шамхалова М.Ш., опубликованной в журнале Сахарный диабет. — 2024. — Т. 27. — №3. — C. 314-320. doi: 10.14341/DM13181.
В списке авторского коллектива допущена ошибка: Петунина Н.А. по ошибке не была указана в составе авторского коллектива данной статьи. Верный состав авторского коллектива следующий: Мокрышева Н.Г., Шестакова М.В., Аметов А.С., Анциферов М.Б., Бакулин И.Г., Вавилова Т.В., Галстян Г.Р., Демидова Т.Ю., Дзгоева Ф.Х., Каронова Т.Л., Лукина Е.А., Мкртумян А.М., Петунина Н.А., Пономарев Р.В., Супонева Н.А., Сухарева О.Ю., Шамхалова М.Ш.
Также неверно был указан идентификатор в системе ORCID для Дзгоевой Ф.Х. Верная ссылка: https://orcid.org/0000-0002-0533-7652
Редакция сожалеет о допущенной ошибке. Исходная версия статьи была заменена.

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).
ISSN 2072-0378 (Online)